Los implantes médicos son una clase especial de dispositivos que son colocados adentro, o sobre la superficie del cuerpo.
Estos dispositivos pueden ser colocados permanentemente, o removidos una vez que ya no son requeridos.
Por ejemplo, los puertos de administración de quimioterapia son implantes no permanentes, lo mismo que los tornillos usados en ortopedia para reparar huesos (se remueven una vez que finaliza el proceso de soldadura del tejido óseo).
Existen algunas creencias erróneas que son comunes sobre este tipo de dispositivos, que revisamos a continuación.
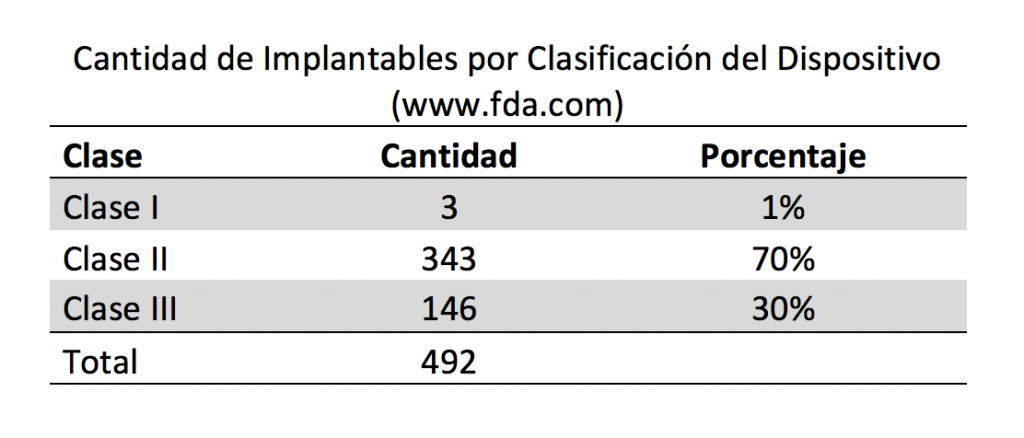
1. No todos los dispositivos implantables son Clase III
La FDA utiliza tres clases regulatorias basados en el riesgo del dispositivo y el nivel de control requerido para asegurar la seguridad y efectividad del mismo.
En esta clasificación, los dispositivos clase I son los que presentan un riesgo mínimo de daño al usuario, mientras que los de clase III son los que presentan el mayor nivel de riesgo.
Existe el concepto generalizado de que todos los implantables son clase III, sin embargo la gran mayoría es clase II y algunos pocos son clase I:
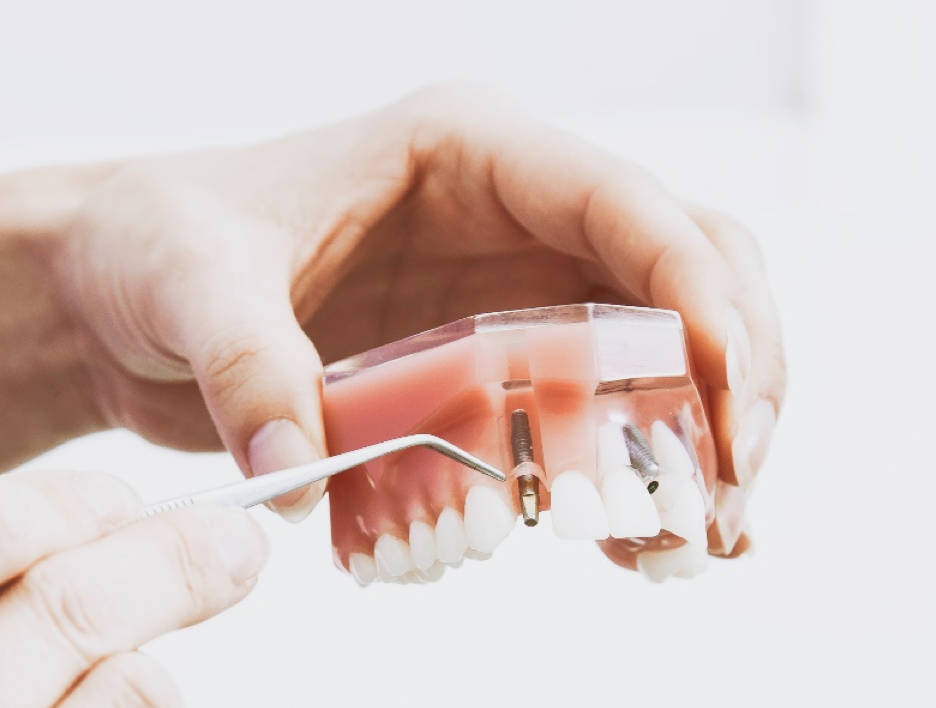
Por ejemplo, los implantes dentales endoóseos son clase I:
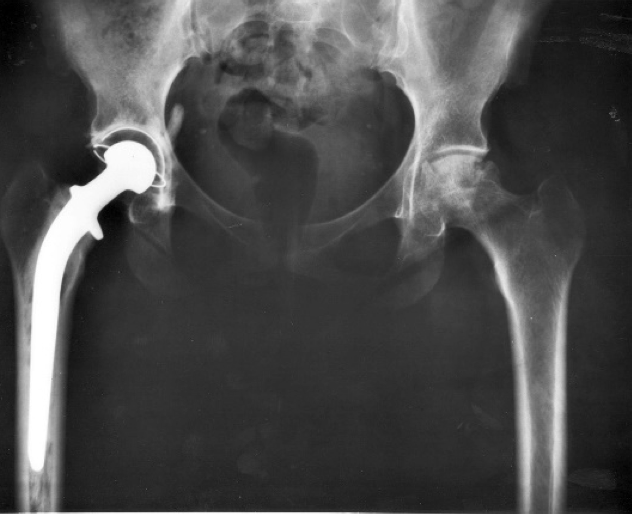
Un ejemplo de implantes clase II son los dispositivos para reemplazo de rodilla y cadera:
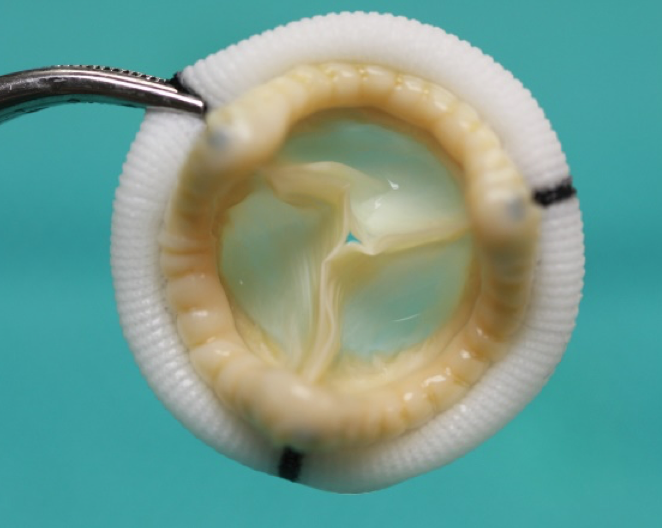
Las válvulas cardiacas son ejemplos de dispositivos Clase III.
2. No todos los dispositivos implantables requieren un PMA
Otro concepto común (y equivocado) es que se requiere de un PMA para todos los implantables.
Sólo los dispositivos clase III, es decir aquellos que presentan un alto riesgo de lesión o enfermedad, requieren aprobación de la FDA previo a la entrada al mercado o PMA (Premarket Approval).
Como vimos en el apartado anterior, la mayoría de los implantables son Clase II, por lo cual no requieren un PMA sino una notificación previa a la entrada al mercado o 510(K) (Premarket Notification).
En un blog anterior explicamos las diferencias entre ambos mecanismos de aprobación por parte de la FDA: 510(k) vs PMA: ¿Cuál es la diferencia?
3. No todos los dispositivos implantables requieren un sistema de rastreo (Medical Device Tracking 21 CFR Parte 821)
El requerimiento de rastreabilidad tiene el propósito de que el manufacturador pueda remover del mercado de la forma más rápida posible los dispositivos defectuosos que puedan causar daño a los pacientes.
Los manufacturadores de los dispositivos para los cuales la FDA ha establecido este requerimiento, deben implementar un procedimiento para rastrear el dispositivo a través de toda la cadena de distribución, hasta el paciente. El requerimiento aplica durante toda la vida útil del dispositivo.
Este apartado de la regulación no es exclusiva de los implantables, sino que puede aplicar a cualquier dispositivo clase II o clase III que esté dentro de una de las siguientes categorías:
- Dispositivos cuya falla podría tener serias consecuencias adversas para la salud del paciente
- Dispositivos que vayan a ser implantados por más de un año
- Dispositivos que son usados para mantener la vida del paciente fuera del ambiente hospitalario
Con base en estos criterios, la FDA mantiene en su página web un listado de los dispositivos que requieren cumplir con la parte 821.
Actualmente sólo 48 tipos de dispositivos están en esa lista, sin embargo, la misma es continuamente actualizada, pues la FDA puede agregar a esta lista dispositivos que antes no estaban incluidos, o eliminar el requerimiento a dispositivos que lo tenían anteriormente.


