
El 2020 fue un año extremadamente difícil para la FDA. La pandemia del COVID-19 requirió reasignar los recursos de la agencia para atender urgencias sin precedentes debido la emergencia de salud pública en los EE.UU.
La respuesta de la FDA se centró en aumentar la disponibilidad de pruebas de diagnóstico, terapias y vacunas para el COVID-19, así como dispositivos médicos específicos como ventiladores y equipos de protección personal.
Adicionalmente, la FDA pospuso el año pasado todas las inspecciones de rutina domésticas (dentro de los EE.UU.) durante cuatro meses para proteger la salud de sus inspectores y los trabajadores de las plantas de manufactura.
La agencia sólo reanudó algunas de las inspecciones domésticas a finales de julio del 2020, y las inspecciones en el extranjero han sido prácticamente suspendidas hasta la fecha.
Ante este panorama, la “Oficina de Rendición de Cuentas” del gobierno estadounidense (GAO, Government Accountability Office) publicó en marzo de 2021 un informe en el que advierte a la FDA sobre el estado de sus inspecciones en la era COVID-19, advirtiendo que la agencia necesita desarrollar herramientas alternativas de inspección y solucionar su falta de inspecciones en el extranjero lo antes posible.
La misión de la FDA es proteger la salud del público estadounidense garantizando la seguridad, eficacia y seguridad de los productos médicos (incluyendo medicamentos, productos biológicos y los dispositivos médicos).
La FDA ha reconocido que el COVID-19 ha desafiado su capacidad para completar las inspecciones requeridas, y ha obligado a que la agencia piense de una manera diferente sobre cómo cumplir su misión de supervisión de la salud pública en el futuro.
La semana pasada la FDA publicó un informe llamado “Hoja de ruta de resiliencia para la supervisión de las inspecciones”.
BSI define la resiliencia organizacional como “la capacidad de una organización para anticipar, prepararse, responder y adaptarse al cambio exponencial y a las interrupciones repentinas para sobrevivir y prosperar”.
En su reporte, la FDA trata sobre:
- El efecto que ha tenido la pandemia en las actividades de inspección para todos los productos regulados por la FDA.
- El uso de herramientas alternativas por parte de la FDA durante la pandemia.
- La clasificación en críticas y prioritarias de las inspecciones utilizada por la FDA durante la pandemia.
- El plan de la FDA para lograr un estado de operaciones más consistente a futuro.
Si bien el reporte abarca todos los productos regulados por la FDA, en este blog nos enfocaremos en los dispositivos médicos.
1. Uso de herramientas alternativas por parte de la FDA durante la pandemia
Durante la pandemia, la FDA ha utilizado su autoridad para solicitar registros y otra información a las compañías en los EE.UU. y en el extranjeros.
El uso de esta autoridad ha apoyado las decisiones de aprobación de solicitudes, ha ayudado a la FDA a identificar áreas de enfoque para futuras inspecciones y ha permitido colocar productos en “alerta de importación” debido a las violaciones regulatorias descubiertas de forma documental.
La FDA también ha realizado revisiones del historial de cumplimiento de las compañías, incluyendo quejas de productos y recalls, para tener un criterio para priorizar las actividades de inspección.
Adicionalmente, la FDA participa en el Programa de Auditoría Única de Dispositivos Médicos (MDSAP, por sus siglas en inglés) en conjunto con Australia, Brasil, Canadá, la Unión Europea y Japón.
La FDA ha utilizado los informes de auditoría de MDSAP en lugar de las inspecciones de monitoreo de la FDA. En 2020, se realizaron auditorías en 2.842 plantas de manufactura de dispositivos médicos y otras 536 se llevaron a cabo este año desde enero a marzo de 2021.
Estas auditorías se realizaron tanto en empresas de dispositivos médicos de los EE.UU. como en el extranjero.

2.Inspecciones clasificadas como críticas durante la pandemia
Al inicio de la pandemia la FDA reservó las inspecciones en sitio sólo para temas denominados como extremadamente necesarios o críticos para la misión de la FDA (“mission ̶ critical”) y pospuso temporalmente todas las inspecciones rutinarias de plantas en los EE.UU. y en el extranjero.

La FDA designó como inspecciones críticas los siguientes casos:
- El producto recibió designación de terapia innovadora.
- El producto se utiliza para tratar una enfermedad o condición médica grave y no hay otro producto sustituto.
- El producto requiere seguimiento debido a un recall, o hay evidencia de eventos adversos graves.
- El producto está relacionado con la respuesta de la FDA al COVID-19 (por ejemplo, escasez del producto).
Las inspecciones identificadas como críticas continuaron para todos los productos regulados, independientemente de la ubicación física de la empresa, ya fuera doméstica o en el extranjero.
En el periodo entre marzo del 2020 a marzo del 2021, la FDA llevó a cabo un total de 821 inspecciones críticas, incluyendo 29 en el extranjero. De estas inspecciones, 8 fueron de dispositivos médicos.
3. Inspecciones clasificadas como prioritarias durante la pandemia
La FDA también estableció el criterio de inspección prioritaria. Este criterio aplicó sólo para las inspecciones domésticas.
Estas inspecciones se definieron como prioritarias en función de los siguientes factores:
- Si la inspección tenía por objeto hacer un seguimiento de una inspección previa donde se encontraron violaciones a las regulaciones.
- Inspecciones para completar una decisión de aprobación de productos en la que no había otra deficiencias en la solicitud que impidieran la aprobación.
- Inspecciones de productos considerados de alto riesgo en virtud de los mandatos legales de frecuencia de inspección.
- Inspecciones que maximizaban el uso de recursos limitados de inspección para lograr el mayor impacto en la salud pública durante la pandemia.
De marzo de 2020 a marzo de 2021, la FDA llevó a cabo un total de 777 inspecciones prioritarias. 72 de estas inspecciones fueron de dispositivos médicos.
Las inspecciones prioritarias incluyeron monitoreo y ciertas inspecciones “for-cause” (por una causa específica) que no caían dentro de la categoría de críticas.
Las inspecciones “for-cause” se realizan cuando existe información, como quejas de calidad del producto, eventos adversos, o incluso la realización de una solicitud a la FDA, que indica un posible problema con los productos de una compañía que justifica una investigación inmediata.
4. La hoja de ruta de la FDA para el futuro
En la Tabla 6 de su reporte, la FDA establece la prioridad que utilizará en el futuro para las inspecciones de dispositivos médicos basada en tres niveles:
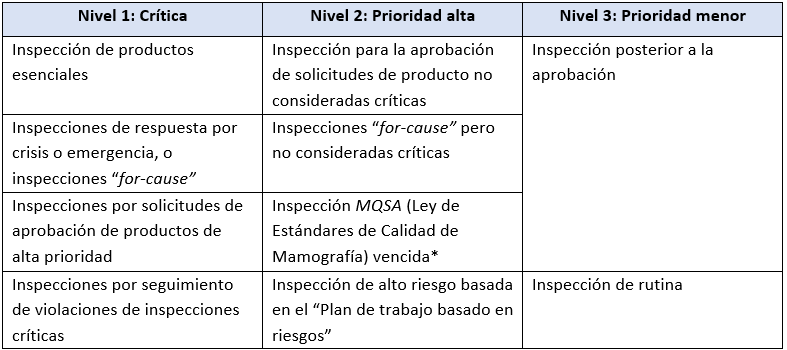
* La frecuencia de inspección está impuesta por ley para realizarse de forma anual
Tal como muestra la tabla, las inspecciones críticas (Nivel 1) seguirán siendo priorizadas en el futuro.
Se seguirán llevando a cabo inspecciones rutinarias; sin embargo, la FDA enfocará sus recursos en las de prioridad alta (Nivel 2).
Por lo tanto, se producirá un intervalo más largo entre las inspecciones para las asignaciones de inspección de prioridad menor (Nivel 3), a medida que la agencia continúe ajustando sus operaciones al impacto del COVID-19.

5. Plan de la FDA para completar las inspecciones no efectuadas
De acuerdo con la FDA, varios factores afectarán la cantidad de inspecciones de que puedan completar durante el resto del año fiscal que termina el 30 de septiembre de 2021.
Debido a los desafíos para la planificación del trabajo en el extranjero, la FDA estima que no habrá inspecciones en el extranjero antes de septiembre de 2021, utilizando personal estadounidense.

La FDA tiene un plan cuyo objetivo es completar las inspecciones pospuestas mediante un enfoque basado en tres escenarios: base, mejor caso y peor caso, dada la continua incertidumbre de la pandemia en curso.
Es importante notar que, en todos los escenarios, la FDA estima que las inspecciones en el extranjero no serían realizables antes de septiembre de este año.
1) Escenario base: transición gradual hacia la reanudación de los niveles operativos estándar
En este escenario, entre julio y septiembre de 2021 la FDA podrá reanudar sus operaciones estándar. Para que esto suceda se requiere que no haya restricciones de viaje o acceso a las plantas.
2) Mejor escenario: transición inmediata a operaciones estándar
Este escenario supone que se levantan de forma inmediata las restricciones de viaje en todos los estados y países, que la FDA puede planificar viajes rápidamente a través de los EE.UU. y al extranjero.
3) Peor escenario: resurgimiento del COVID-19, continúa el estado de operaciones de emergencia con restricciones más estrictas
En el peor escenario, surgen nuevas variantes y/o se producen nuevos resurgimientos del COVID-19, por lo que hay un riesgo significativo para el personal de la FDA.
Se imponen restricciones significativas a los viajes y/o restricciones al acceso a las plantas de manufactura para protección de los trabajadores. Hay pocos o ningún lugar seguro para llevar a cabo inspecciones.

Resumen
- Existe preocupación en el gobierno estadounidense por la disminución en la cantidad de inspecciones en sitio desde el inicio de la pandemia tanto en los EE.UU. como en el extranjero.
- De acuerdo con las directrices de las autoridades sanitarias estadounidenses y de los diferentes países, la FDA ha suspendido aquellas inspecciones que pudieran poner en riesgo la salud de los inspectores o del personal de las compañías manufacturadores.
- En respuesta a la limitación para realizar inspecciones en sitio, la FDA ha recurrido a herramientas alternativas tales como la solicitud de documentos para revisión, las revisiones del historial de cumplimiento de las compañías, y su participación en el programa MDSAP.
- Al principio de la pandemia, la FDA estableció criterios para clasificar las inspecciones como críticas para cumplir la misión de la FDA de proteger la salud del público estadounidense garantizando la seguridad, eficacia y seguridad de los productos médicos. Debido a su criticidad, estas inspecciones se llevan a cabo ya sea dentro de los EE.UU. o en el extranjero según sea necesario.
- La FDA también estableció criterios para las inspecciones prioritarias, sin embargo, estas sólo se llevan a cabo a nivel doméstico.
- En su “Hoja de ruta de resiliencia para la supervisión de las inspecciones”, la FDA establece la metodología que utilizará en el futuro para las inspecciones de dispositivos médicos basada en tres niveles de prioridad: críticas, prioridad alta y prioridad menor.
- Finalmente, la FDA presentó un plan para completar antes de setiembre de este año (FY2021) las inspecciones pospuestas con base en tres escenarios: base, mejor caso y peor caso, dada la continua incertidumbre de la pandemia.
Este es un pequeño resumen del informe, sin embargo, lo incluimos en las referencias para que lo pueda leer en su totalidad.
Referencias
Resiliency Roadmap for FDA Inspectional Oversight
Créditos fotográficos:
Unsplash
Pixabay


