En un blog anterior presentamos “Los 8 Requerimientos Básicos” para implementar un sistema de CAPA robusto y capaz de pasar una inspección de la FDA con cero observaciones.
En esta ocasión revisamos “la otra cara de la moneda”: algunas deficiencias comunes en los sistemas de CAPA, los cuales hay que evitar para de igual manera pasar bien la inspección.
- No asignar los recursos necesarios para el sistema de CAPA.
Para desarrollar e implementar una buena acción correctiva se requiere de un equipo de trabajo interdisciplinario. Entre los miembros del equipo se debe contar con personal familiarizado con los procesos de la organización, miembros de diferentes áreas funcionales, además de al menos una persona capacitada en el proceso de CAPA que pueda servir de facilitador del equipo.
Cuando a los miembros del equipo tienen conflictos de prioridades, o si sus prioridades de trabajo cambian constantemente, el proceso de CAPA pierde efectividad. Aquí es cuando nos encontramos con:
- CAPAs que no se completan dentro de un periodo de tiempo adecuado: cuando la organización no ha asignado los recursos adecuados para realizarla de forma diligente, la acción correctiva se extiende más allá del tiempo establecido por la organización.
- CAPAs recurrentes: cuando el equipo no le ha dedicado a la acción correctiva el tiempo y esfuerzo necesario para realizar una buena investigación y desarrollar un plan de acción efectivo, el problema de fondo no se soluciona y se genera recurrencia.
- No proveer entrenamiento técnico al personal involucrado en CAPA.
La asignación de desarrollar e implementar una acción correctiva eficaz se debe dar a personal capacitado en dos aspectos básicos:
- Herramientas de análisis de causa raíz. Si no se usan herramientas ingenieriles para realizar el análisis de causa raíz, las investigaciones serán poco robustas, los planes de acción no serán efectivos y habrá problemas de recurrencia.
- Redacción técnica (technical writing). Hasta la investigación mejor realizada puede recibir observaciones en una auditoria, sino ha sido bien escrita. Un CAPA es un registro del sistema de calidad y un documento técnico que debe ser claro, robusto y auto explicativo (self-explanatory), de forma que al presentarlo a un auditor a este no le queden dudas de que se implementó un plan de acción robusto.
- No analizar todas las fuentes de datos de calidad (muchas veces denominados “feeder systems”).
El proceso de CAPA debe abarcar todas las fuentes de datos de calidad que permitan identificar necesidades de acciones correctivas o preventivas. A continuación se presentan algunos ejemplos de fuentes de datos que deben analizarse:
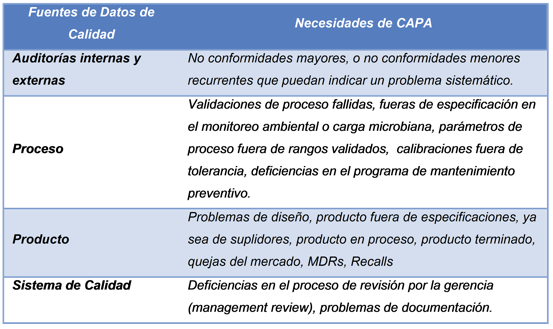
- Falta de un análisis adecuado de los datos.
Las fuentes de datos de calidad deben analizarse de manera periódica y utilizando metodología estadística. Se debe analizar las métricas relevantes de cada fuente de datos y realizar un análisis de tendencias de forma periódica (por ejemplo, mensual o trimestralmente).
Los métodos utilizados más comúnmente son los gráficos de tendencias y los diagramas de Pareto.
- Falta de acciones preventivas
Finalmente, un sistema de CAPA debe tener acciones preventivas. Muchas compañías se enfocan sólo en solucionar problemas de calidad inmediatos (modo reactivo), en lugar de prevenirlos antes de que sucedan (modo proactivo).
Para identificar acciones preventivas, puede establecerse un equipo de trabajo que identifique problemas potenciales u oportunidades de mejora en las diferentes áreas y procesos de la compañía. De esta forma, el Sistema de CAPA proveerá un mayor valor agregado a la organización.



